전체 수집건수 중 약 30%…모니터링센터 16개소 확대
지난해 의료기기 부작용 사례가 가장 많이 수집된 품목은 '인공유방'으로 나타난 가운데 식약처가 전국 지역별 거점 종합병원을 중심으로 운영 중인 '의료기기 안전성정보 모니터링 센터'를 16개소로 확대 운영한다고 17일 밝혔다.

의료기기 안전성정보 모니터링 센터는 의료기관에서 발생한 부작용 사례에 대한 집중 모니터링을 위한 전국 지역별 거점 종합병원.
2011년 6개소를 지정·운영하기 시작해 2012년 10개소, 2013년 12개소로 확대됐다.
의료기기 부작용 사례 모니터링 결과 수집되는 정보는 해마다 증가 추세에 있으며 지난해의 경우 4556건으로 전년대비 10.3% 증가했다.
이중 의료기관을 통해 수집되는 부작용 사례도 해마다 증가하고 있고, 지난해 2040건으로 전체 사례 중 약 45%를 차지하고 있다.
이는 2011년부터 시작한 의료기기 안전성 정보 모니터링 센터 확대 운영과 보고 체계 내실화에 따라 의료기기 부작용 사례보고가 꾸준히 증가하고 있는 것으로 분석된다.
의료기관 이외 부작용 사례는 의료기기 제조·수입업체(54.9%)를 통해 수집되거나 또는 일반국민(0.07%)이 직접 식약처에 신고하는 경우도 있다.
부작용 사례가 수집된 의료기기 품목은 2011년 105개 품목, 2012년 284개 품목, 2013년 372개 품목, 2014년 366개 품목으로 다양화되고 있다.
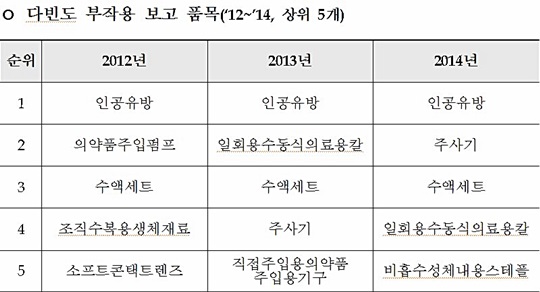
특히 지난해 부작용 사례가 가장 많이 수집된 품목은 '인공유방'(1326건)으로 전체 부작용 사례 건수(4556건)의 29.1%를 차지했고, 주사기(288건)·수액세트(245건) 등이 뒤를 이었다.
이중 실리콘겔인공유방의 경우 부작용 사례는 제품파열이 596건으로 가장 많았고 구형구축(228건)·모양변형(16건) 등의 순이었다.
식약처는 "의료기기 부작용 사례 모니터링은 의료기기로 인한 피해 확산 방지와 허가 시 예상하지 못했던 부작용 사례에 대한 정보 수집을 통해 제품 허가사항에 반영하는 등 안전사용을 위한 실마리 정보로 사용된다"고 설명했다.
이어 "의료기기 사용으로 인해 부작용이 발생하는 경우에는 식약처 의료기기안전평가과(043-230-0456)와 식약처 부작용보고시스템(emed.mfds.go.kr) 또는 전국 16개 거점 종합병원을 통해 반드시 보고해 줄 것"을 당부했다.

2011년 6개소를 지정·운영하기 시작해 2012년 10개소, 2013년 12개소로 확대됐다.
의료기기 부작용 사례 모니터링 결과 수집되는 정보는 해마다 증가 추세에 있으며 지난해의 경우 4556건으로 전년대비 10.3% 증가했다.
이중 의료기관을 통해 수집되는 부작용 사례도 해마다 증가하고 있고, 지난해 2040건으로 전체 사례 중 약 45%를 차지하고 있다.
이는 2011년부터 시작한 의료기기 안전성 정보 모니터링 센터 확대 운영과 보고 체계 내실화에 따라 의료기기 부작용 사례보고가 꾸준히 증가하고 있는 것으로 분석된다.
의료기관 이외 부작용 사례는 의료기기 제조·수입업체(54.9%)를 통해 수집되거나 또는 일반국민(0.07%)이 직접 식약처에 신고하는 경우도 있다.
부작용 사례가 수집된 의료기기 품목은 2011년 105개 품목, 2012년 284개 품목, 2013년 372개 품목, 2014년 366개 품목으로 다양화되고 있다.
이중 실리콘겔인공유방의 경우 부작용 사례는 제품파열이 596건으로 가장 많았고 구형구축(228건)·모양변형(16건) 등의 순이었다.
식약처는 "의료기기 부작용 사례 모니터링은 의료기기로 인한 피해 확산 방지와 허가 시 예상하지 못했던 부작용 사례에 대한 정보 수집을 통해 제품 허가사항에 반영하는 등 안전사용을 위한 실마리 정보로 사용된다"고 설명했다.
이어 "의료기기 사용으로 인해 부작용이 발생하는 경우에는 식약처 의료기기안전평가과(043-230-0456)와 식약처 부작용보고시스템(emed.mfds.go.kr) 또는 전국 16개 거점 종합병원을 통해 반드시 보고해 줄 것"을 당부했다.







