대한핵의학회에서 FC705의 안정성과 유효성 입증
국내 2상‧미국 1/2a상 진입 및 라이선스 아웃 목표
지난 4일부터 6일까지 진행된 대한핵의학회 추계학술대회 및 총회에서 퓨쳐켐은 거세저항성 전립선암 환자에서의 루도타다이펩 임상 1상 연구라는 주제로 전립선암 치료제 FC705의 임상 1상 중간 결과를 발표했다.
FC705 국내 임상 1상은 서울성모병원에서 전이성 거세저항성 전립선암(mCRPC) 환자 30명을 6명씩 5개 그룹으로 용량을 증가(50mCi~150mCi)하며 투여 후, 8주간 안정성과 유효성 평가 및 적절한 용량을 결정하기 위한 임상을 진행 중에 있다.
이번 발표에서는 퓨쳐켐의 전립선암 치료제 후보물질 FC705의 임상 1상 30명의 환자 중 이미 결과를 확인한 100 mCi까지 투여한 환자 그룹과 현재 진행 중에 있는 125mCi를 투여한 환자에 대한 중간 결과를 발표한 것이다.
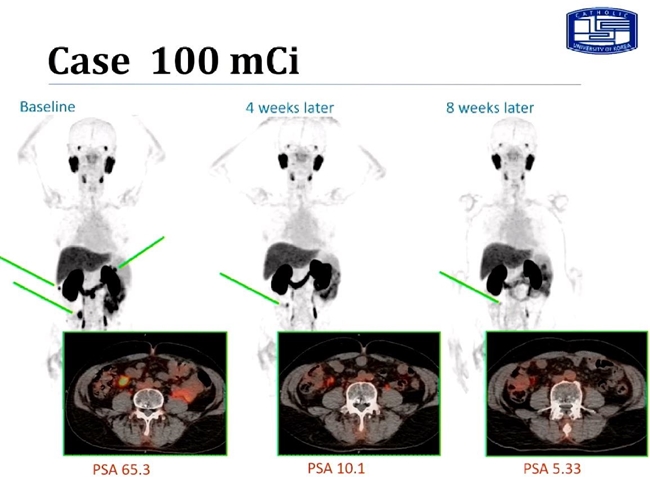
발표에 따르면 50 mCi, 75 mCi 군에선 PSA 감소를 보인 대상자가 1명 또는 2명으로 확인됐지만 100 mCi 군에선 6명 중 5명의 대상자에서 PSA 수치가 감소를 확인했다.
실제 임상시험 참여자 중 PSA 65에서 등록된 환자에게 FC705 100 mCi를 1회 투여하고 8주까지 PSA와 PSMA-PET을 통한 유효성을 평가했고, 4주 후에는 PSA수치가 10.1, 8주 후에는 PSA가 5.3으로 약 92% 감소된 것으로 나타났다
또한 이번 발표에서는 현재 진행 중인 125 mCi 투여군에 대한 치료 효과도 발표됐다.
등록 당시 98.6였던 PSA 수치가 125 mCi 투여 4주 후 20.8(약 79%)까지 감소되는 것을 확인했고 대체적으로 투여 후 8주까지 PSA가 감소하는 것을 감안했을 때 더 큰 감소를 보일 것으로 예측됐다.
이와 함께 안전성 평가는 방사선 유효선량 값을 통해 검증했으며, 기존 Lu-177 의약품에서 높은 섭취를 보이는 골수나 침샘에서의 흡수가 상대적으로 낮아 이로 인한 부작용이 적을 것으로 평가됐다.
이밖에 100 mCi까지 투여한 결과 현재까지 임상적으로 유의미한 부작용이 관찰된 환자는 없었고 이는 경쟁 의약품 대비 낮은 방사선 용량을 투여하기 때문이라고 예측했다.
퓨쳐켐 관계자는 "FC705은 적은 용량을 투여함에도 높은 치료 효과를 보였고 낮은 방사선 독성으로 인해 안정성이 높다"며 "최근 발표된 비임상시험에 대한 결과를 통해 예측했던 경향성이 본 임상을 통해 재확인됐다고 판단한다"고 밝혔다.
그는 이어 "임상 1상을 성공적으로 마무리하고 반복투여가 가능한 국내 임상 2상과 미국 임상 1/2a상 진입에 박차를 가함과 동시에 글로벌 제약, 바이오 기업 등 라이선스 아웃 계약을 체결할 수 있는 파트너는 모색할 계획"이라고 덧붙였다.







