안전관리 체계 확립·국제 경쟁력 강화·치료기회 확대 목표 설정
"글로벌 경쟁력 강화로 환자 중심 신약개발 강국 실현"
식품의약품안전처가 희귀·난치환자 등의 치료기회 확대와 임상시험 참여자의 권익보호를 중심으로 하는 임상시험 계획 발전 5개년 종합계획을 수립했다.
8일 식약처는 임상시험 안전관리 체계 확립과 임상시험 국제 경쟁력 강화, 환자 치료기회 확대 및 소통체계 구축의 세 가지 축을 큰 틀로 하는 계획을 발표했다.
임상시험은 의약품의 안전성과 유효성을 검증하는 단계로, 국내 임상시험 참여자가 최근 연간 10만 명을 넘어서고 있어 임상시험 참여자에 대한 안전관리 강화 요구가 높아지고 있다.
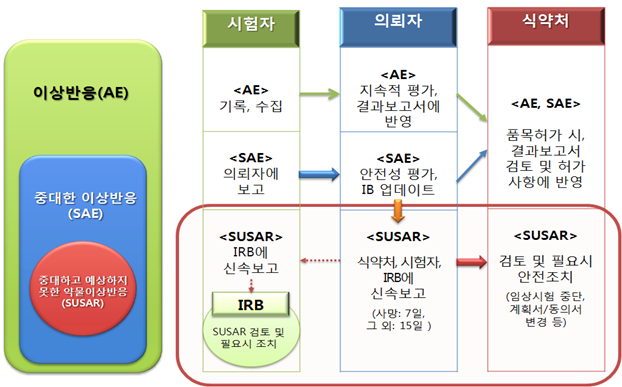
이상반응 관리 체계도
특히, 최근에는 신약개발 경향이 희귀질환제 개발로 변화되면서 임상시험 참여가 곧 치료기회로 이어지고 있는 추세로, 임상시험 참여에 대한 욕구가 높아짐에 따라 체계적 관리도 필요한 상황이다.
이에 식약처는 '임상시험 글로벌 경쟁력 강화로 환자 중심 신약개발 강국 실현'을 목표로 임상시험 발전을 위한 3대 추진전략과 21개 세부과제를 마련했으며, 올해 1월부터 임상시험 제도 발전 추진단 통해 다양한 의견을 수렴했다.
먼저 '마루타 알바' 등 환자 관리 부실에 대해 대대적인 손질을 가했다.
식약처는 임상시험에 사용되는 의약품의 모든 안전성 정보에 대해 정기보고를 의무화하고, 국가에서 적극적으로 관리·감독해 안전 관리를 강화한다.
중대하고 예측하지 못한 부작용 등 주요 안전성 정보를 국가에 보고하고, 고 위험도의 임상시험의 경우 임상시험실시기관(병원) 등에 대한 정기점검과 더불어 품목별 특별점검을 강화하는 등 사후관리 체계를 개편 할 계획이다.
또 점검 시 그 결과를 공개해 안전관리의 투명성과 신뢰성을 확보하고 임상시험 참여환자의 안전 및 권리보호를 위해 공공적 성격의 '중앙임상시험심사위원회' 및 국가에서 운영하는 '도우미센터' 설립을 추진한다.
세계 최고 수준 인프라 구축으로 편리한 임상시험 환경을 구축하겠다는 계획도 나왔다.
식약처는 안전성이 확보된 임상시험은 임상약 정보 등 필수정보 만으로 승인하는 '차등 승인제'를 단계적으로 도입해, 임상시험 조기 진입을 통한 국내 환자의 치료기회를 보다 확대한다.
임상시험 예측성 강화를 위해 5일내 제출자료의 완결성을 확인하도록 '예비검토제'를 시행하고, 심사의 일관성과 효율적 심사를 위해 '임상시험 심사TF'를 구성·운영한다.
식약처는 "환자 치료기회 확대 및 국민소통을 통해 사회 안전망을 확충하겠다"며 "임상시험에 참여하는 환자에게 올바른 정보를 사전에 제공하고 수행과정의 객관성·투명성을 확보하기 위해 정보공개 시스템을 구축·운영하겠다"고 밝혔다.
국내에 치료제가 없는 희귀·난치환자를 위해 '긴급' 승인절차를 마련하는 등 환자 중심으로 임상시험약 치료목적사용 승인절차를 개선한다.
국가임상시험지원재단 등 관련 기관과 협업을 강화하고 임상시험에 대한 대국민 소통채널을 다양화하고 국제 협력사업을 확대해, 우리나라의 우수한 임상시험 관리수준을 해외에 널리 알리겠다는 게 식약처의 계획.
식약처는 "이번 임상시험 발전 5개년 종합계획 수립을 통해 안전과 신뢰가 확보된 임상시험으로 국민 건강수명 연장과 삶의 질 향상에 기여하는 한편, 신약 개발 강국으로 도약하는 밑거름이 될 것으로 기대한다"고 밝혔다.
8일 식약처는 임상시험 안전관리 체계 확립과 임상시험 국제 경쟁력 강화, 환자 치료기회 확대 및 소통체계 구축의 세 가지 축을 큰 틀로 하는 계획을 발표했다.
임상시험은 의약품의 안전성과 유효성을 검증하는 단계로, 국내 임상시험 참여자가 최근 연간 10만 명을 넘어서고 있어 임상시험 참여자에 대한 안전관리 강화 요구가 높아지고 있다.

이에 식약처는 '임상시험 글로벌 경쟁력 강화로 환자 중심 신약개발 강국 실현'을 목표로 임상시험 발전을 위한 3대 추진전략과 21개 세부과제를 마련했으며, 올해 1월부터 임상시험 제도 발전 추진단 통해 다양한 의견을 수렴했다.
먼저 '마루타 알바' 등 환자 관리 부실에 대해 대대적인 손질을 가했다.
식약처는 임상시험에 사용되는 의약품의 모든 안전성 정보에 대해 정기보고를 의무화하고, 국가에서 적극적으로 관리·감독해 안전 관리를 강화한다.
중대하고 예측하지 못한 부작용 등 주요 안전성 정보를 국가에 보고하고, 고 위험도의 임상시험의 경우 임상시험실시기관(병원) 등에 대한 정기점검과 더불어 품목별 특별점검을 강화하는 등 사후관리 체계를 개편 할 계획이다.
또 점검 시 그 결과를 공개해 안전관리의 투명성과 신뢰성을 확보하고 임상시험 참여환자의 안전 및 권리보호를 위해 공공적 성격의 '중앙임상시험심사위원회' 및 국가에서 운영하는 '도우미센터' 설립을 추진한다.
세계 최고 수준 인프라 구축으로 편리한 임상시험 환경을 구축하겠다는 계획도 나왔다.
식약처는 안전성이 확보된 임상시험은 임상약 정보 등 필수정보 만으로 승인하는 '차등 승인제'를 단계적으로 도입해, 임상시험 조기 진입을 통한 국내 환자의 치료기회를 보다 확대한다.
임상시험 예측성 강화를 위해 5일내 제출자료의 완결성을 확인하도록 '예비검토제'를 시행하고, 심사의 일관성과 효율적 심사를 위해 '임상시험 심사TF'를 구성·운영한다.
식약처는 "환자 치료기회 확대 및 국민소통을 통해 사회 안전망을 확충하겠다"며 "임상시험에 참여하는 환자에게 올바른 정보를 사전에 제공하고 수행과정의 객관성·투명성을 확보하기 위해 정보공개 시스템을 구축·운영하겠다"고 밝혔다.
국내에 치료제가 없는 희귀·난치환자를 위해 '긴급' 승인절차를 마련하는 등 환자 중심으로 임상시험약 치료목적사용 승인절차를 개선한다.
국가임상시험지원재단 등 관련 기관과 협업을 강화하고 임상시험에 대한 대국민 소통채널을 다양화하고 국제 협력사업을 확대해, 우리나라의 우수한 임상시험 관리수준을 해외에 널리 알리겠다는 게 식약처의 계획.
식약처는 "이번 임상시험 발전 5개년 종합계획 수립을 통해 안전과 신뢰가 확보된 임상시험으로 국민 건강수명 연장과 삶의 질 향상에 기여하는 한편, 신약 개발 강국으로 도약하는 밑거름이 될 것으로 기대한다"고 밝혔다.








