글로벌 매출 4조원대 루센티스 추격…가격 경쟁력 변수
지난해 시밀러 5종 해외 시장 매출 약 3544억원 성과
삼성바이오에피스가 안과 질환에서 첫 바이오시밀러인 바이우비즈를 출시하며 본격적인 미국시장 공략에 나선다.
미국 식품의약국(FDA)의 허가를 바은 최초의 루센티스 바이오시밀라는 점에서 시장 선점도 기대해볼 수 있는 상황. 이미 가격 경쟁력을 바탕으로 시장을 넓히고 있는 상황에서 어느 정도의 시장성을 가져갈 수 있을지 주목된다.

삼성바이오에피스(이하 에피스)는 현지시각으로 지난 2일 미국 시장에서 안과질환 치료제 '바이우비즈(미국 상품명 BYOOVIZ, 프로젝트명 SB11, 성분명 라니비주맙)' 를 출시했다고 밝혔다.
바이우비즈는 로슈와 노바티스가 판매하는 습성 연령유관 황반변성, 당뇨병성 황반부종 등의 안과질환 치료제인 루센티스(Lucentis)의 바이오시밀러 제품이다.
이미 에피스는 지난 해 8월과 9월 각각 유럽과 미국에서(상품명 바이우비즈) 그리고 올해 5월 한국에서(상품명 아멜리부) 모두 최초로 루센티스 바이오시밀러 판매 허가를 획득하면서 제품 출시를 예고한 바 있다. 그 중 가장 먼저 미국 시장에서 치료제를 내놓게 된 셈이다.
앞선 임상결과를 살펴보면 2018년 3월부터 2019년 12월까지 총 705명의 습성(신생혈관성) 연령유관 황반변성(nAMD) 환자들을 대상으로 한 글로벌 3상에서 바이우비즈는 루센티스 간의 비교 연구를 진행해 52주간 처방을 유지한 환자 634명의 데이터를 기반으로 의약품 효능 및 약동학(PK:Pharmakokinetics), 면역원성 안전성 등에서 동등성을 확인했다.
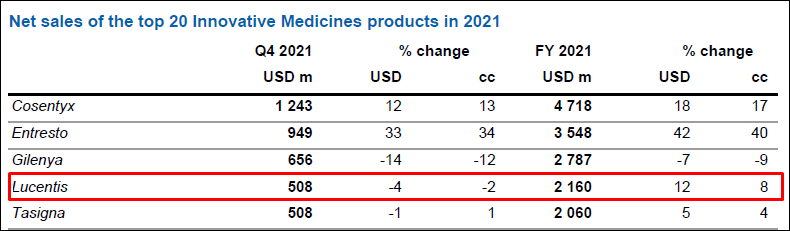
현재 루센티스는 지난해 지난 해 연간 제품 매출이 약 4.4조원을 기록한 블록버스터 약물로 이 중 미국 시장에서만 13억5300만 스위스프랑(약 1.8조원)으로 전체 매출의 약 41%를 차지했다.
노바티스의 지난해 연간보고서를 살펴봤을 때도 루센티스는 노바티스 전체 약물에서 코센틱스, 엔트레스토 길레니아에 이은 매출 순위 4위를 기록하며 아직까지도 주력 매출 제품인 상태다.
결국 에피스가 아직 글로벌 시장에서 매출 영향력을 발휘하고 있는 루센티스 시장을 노리기 위한 첫 발을 뗀 셈이다.
바이우비즈는 단일사용량(0.5mg) 기준 오리지널 의약품 대비 약 40% 저렴한 1130달러의 도매가격(WAC)으로 미국 시장에 출시해 가격경쟁력을 확보했다.
에피스가 보유한 바이오시밀러 5종이 올해 1분기 한국을 제외한 해외 시장에서 2억9230만달러(약 3544억원)의 매출을 올리며 꾸준한 성장세를 기록했다는 점을 고려했을 때 바이우비즈 역시 미국 시장에 안착할 가능성이 높다.
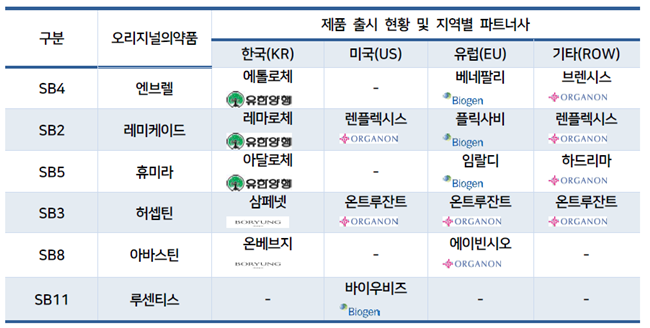
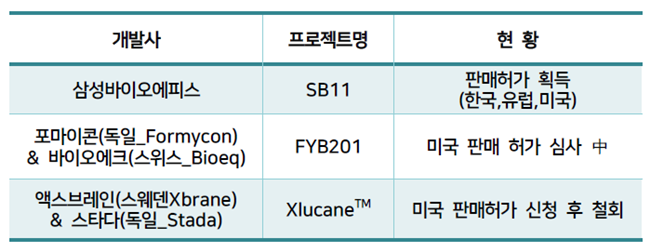
특히, 지난 5월 30일 기준 루센티스 바이오시밀러 판매허가를 획득한 기업은 에피스가 유일하다는 점을 고려했을 때 한동안 시장에서 영향력을 발휘할 것이란 전망이다.
에피스에 따르며 포마이콘(독일)과 바이오에크(스위스)의 루센티스 바이오시밀러는 아직 미국 판매 허가심사가 진행 중이며, 액스브레인(스웨덴)과 스타다(독일)의 바이오시밀러는 미국 판매허가 신청 후 철회한 것으로 알려졌다.
에피스의 경우 제넨텍과의 라이선스 계약에 따라 미국에서는 제넨텍의 해당 SPC(의약품 추가보호 증명) 만료 전인 2022년 6월부터 제품을 판매가 가능한 상황. 이외 지역에서는 제넨텍의 SPC 만료 이후부터 제품을 판매할 수 있다.
다만, 바이우비즈의 미국 마케팅 파트너사가 바이오젠이라는 점은 시장안착에 변수로 작용할 가능성도 있다.
기존에 미국 시장에 진출한 에피스의 바이오시밀러는 레미케이드의 시밀러인 렌플렉시스와, 허셉틴의 시밀러인 온트루잔트로 오가논이 마케팅 파트너사를 담당해 왔었다.
바이오젠의 경우 유럽지역을 중심으로 마케팅을 담당해 왔으며, 이번에 처음으로 에피스의 시밀러를 미국 시장에서 담당한 만큼 시장진입 초기단계에 얼마나 영향력을 발휘할 수 있을지는 지켜봐야할 부분이다.
또 에피스 입장에서 바이우비즈의 시장 안착이 중요한 이유는 마찬가지로 블록버스터 황반변성 치료제인 바이엘의 아일리아의 바이오시밀러 임상 3상을 진행하고 있기 때문이다.
에피스는 지난 3월 2번째 안과질환 치료제인 SB15(아일리아 바이오시밀러, 성분명 애플리버셉트)의 글로벌 임상 3상을 완료했다고 공시한 상태다.
아일리아 물질특허 만료는 현재 유럽은 2025년 5월 그리고 미국은 2023년 6월로 설정돼 있다.
후속 특허 이슈가 있을 수 있지만 내년에 아일리아의 미국특허 만료가 예정돼 있는 상황에서 에피스가 이번에 출시한 바이우비즈의 시장안착에 따라 같은 황반변성 치료제인 아일리아의 바이오시밀러까지 연속해 영향력을 확보하는 교두보가 될 수 있다는 의미다.
삼성바이오에피스 관계자는 "글로벌 자가면역질환 치료제 및 항암제 시장에서 당사의 제품 매출을 확대해 나가고 있다"며 "올해는 안과질환 치료제 분야의 시장을 새롭게 개척함으로써 지속적인 성장 기반을 구축해 나갈 계획이다"고 말했다.








