허가-평가-협상 병행 시범사업 첫 사례…암질심 통과
12개월 이상 소아 신경모세포종에 급여기준 마련
작년에 '허가-평가-협상 병행 시범사업' 1호 약제로 선정된 위험 신경모세포종 치료제 '콰지바(디누툭시맙)'가 국내 품목허가가 이뤄지기도 전 급여 첫 관문을 통과했다.
허가급여협상 연계제도는 의약품 허가 전이라도 보험약제의 급여결정 시점을 줄이기 위해 마련된 일종의 패스트트랙이다.
건강보험심사평가원(심평원)은 29일 2024년 제4차 암질환심의위원회를 열고 급여기준 심의결과를 공개하며 이같이 밝혔다.
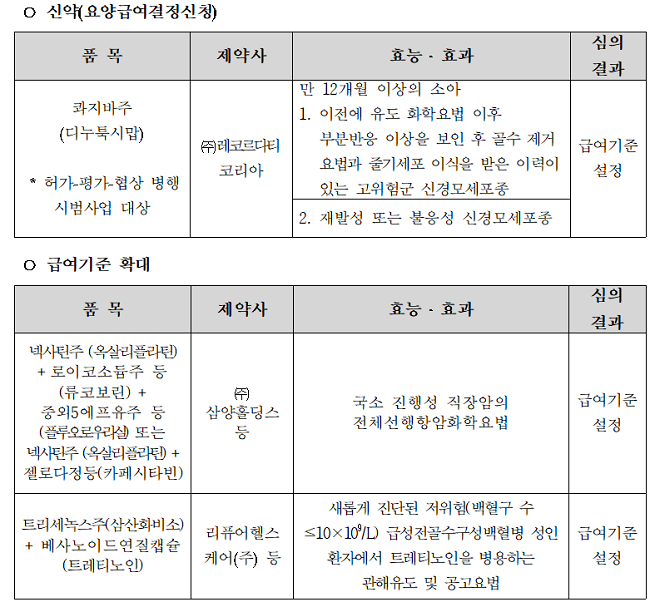
그중 레코르다티코리아 쾨지바에 대한 급여기준이 신규 설정됐다. 급여 적응증은 만 12개월 이상의 소아에서 ▲이전에 유도 화학요법 이후 부분반응 이상을 보인 후 골수 제거요법과 줄기세포 이식을 받은 이력이 있는 고위험군 신경모세포종 ▲재발성 또는 불응성 신경모세포종이다.
이 약제는 앞서 지난해 6월 허가신청-급여평가-약가협상 병행 시범사업 1호 약제로 선정된 바 있으며, 지난해 8월에는 식품의약품안전처 글로벌 혁신제품 신속심사('GIFT) 대상으로 지정됐다.
또한 암질심은 이날 국소 진행성 직장암 치료에서 삼양홀딩스 '넥사틴주(옥살리플라틴)' 병용요법에 대한 급여기준을 확대됐다.
이외에도 '트리세녹스주(삼산화비소)'이 새롭게 진단된 저위험 급성전골수구성백혈병 성인 환자 관해유도 및 공고요법으로서 트레티노인과 병용으로 급여기준이 설정됐다.
이외에도 심평원은 6개 항목에서 임상현실을 반영해 급여기준을 확대했다고 밝혔다.
지난해 12월 대한의사협회, 대한병원협회 등 각 의학회로부터 문제제기 되고 있는 급여기준에 대하여 개선의견을 수렴해 약제, 행위, 치료재료 전반에 걸쳐 의료계, 학회 등과 긴밀한 소통을 통해 개선 검토를 적극적으로 진행하고 있다는 설명이다.
부인과암(자궁경부암) 2건을 비롯한 ▲유방암(1건) ▲식도암(1건) ▲비뇨기암(2건) 등에서 급여기준을 확대됐다.
동시에 방사성 치료제 '루타테라주(루테튬(177Lu)옥소도트레오타이드)'도 암질심 사용승인을 통해 신경내분비종양 2차 치료제로서 일부 사용이 승인됐다.
사용승인제란 식약처 허가 또는 신고범위 초과 항암요법이더라도 신청 요양기관은 다학제적위원회 심의를 거쳐 신청 후 암질심의 사용승인 결과에 따라 쓸 수 있게 하는 제도를 말한다. 단, 신청요양기관에 한해 사용 가능하며 약제비는 전액 본인부담한다.








