식약처, 26일 대통령 업무보고 통해 발표
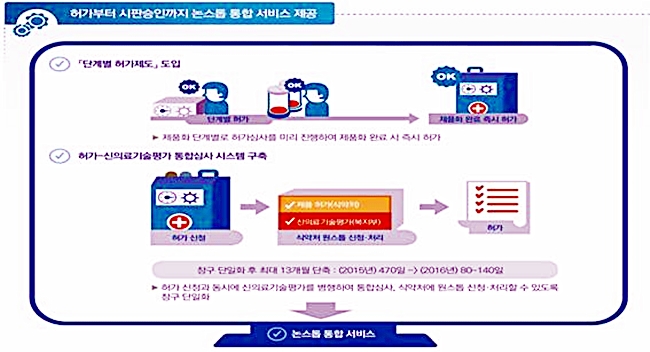
식약처는 첨단 융·복합의료기기와 관련해 허가부터 시판승인까지 통합적으로 서비스를 제공하는 논스톱 허가시스템을 구축하고 개발부터 수출까지 전주기 맞춤형 지원을 강화키로 했다.
또 제품화 단계별로 허가 심사를 미리 진행해 제품화 완료 시 즉시 허가하는 ‘단계별 허가제도’를 도입한다.
특히 식약처 허가 신청과 동시에 복지부·보건의료연구원의 신의료기술평가를 병행해 통합심사하고 원스톱으로 신청·처리할 수 있도록 창구 단일화를 골자로 ‘허가-신의료기술평가 통합심사시스템’ 구축 계획도 밝혔다.
더불어 세계시장 선점이 유망한 신 개념 융·복합 제품 100개를 오는 2020년까지 차세대 유망 의료기기로 선정해 맞춤형 멘토링을 지원할 계획이다.
이밖에 ‘의료기기 통합정보BANK’를 가동해 10대 수출 대상국(미국 중국 독일 일본 러시아 인도 브라질 영국 이란 터키)의 시장·규제·허가 등에 대한 심층 정보 제공과 맞춤형 콘텐츠를 지속적으로 발굴하다.







