심평원, 재평가 계획 확정하고 설명회 거쳐 추진 예정
생동성 시험 가격 인상 압박 속 제네릭 포기현상 벌어져
건강보험심사평가원이 국내 제약사들의 복제 의약품(제네릭) 난립을 막기 위해 추진 중인 '기등재 의약품 상한금액 재평가'를 본격 실시한다.
제시한 기준요건을 충족하지 못할 경우 급여 등재된 품목의 약가를 재평가해 조정하는 것이 골자로 대상은 지난 2020년 8월 1일에 등재된 품목 기준이다. 다만, 주사제, 점안제 등 생동성 확대 품목의 경우 자료제출 기한이 추가로 유예된다.

9일 제약업계에 따르면, 심평원은 이 같은 내용을 골자로 한 '기등재 의약품 상한금액(기준요건) 재평가' 계획을 확정하고 설명회 등 의견수렴을 거쳐 본격 진행할 예정이다.
재평가의 배경은 2018년 발사르탄 의약품 불순물 검출 사태. 주된 내용은 '동일 제제 동일가'는 유지하되 제약사의 개발 및 품질관리 노력에 따라 보상체계가 다르게 적용되도록 기준 요건 충족 여부를 판단해 약가에 차등을 두겠다는 것이다.
즉, 이번 재평가의 경우 '기준 요건' 충족 여부가 핵심인 셈이다.
여기서 심평원이 제시한 기준요건은 자체 생물학적 동등성 시험 자료 또는 임상시험 수행 입증 자료와 등록된 원료 의약품 사용 입증 자료 등으로 재평가 대상 품목을 가진 제약사는 시기에 맞춰 내년 2월 말까지 제출해야 한다.
제네릭이 주요 대상인 재평가를 두고서 심평원은 2020년 8월 약제급여목록 및 상한금액표에 이름이 오른 품목을 대상으로 한다고 안내하고 있다. 다시 말해, 당시 급여 등재돼 있는 각 제약사 품목 대부분 생동성 혹은 임상시험 자료, 원료 의약품 자료 등을 제출해야 하는 셈이다.
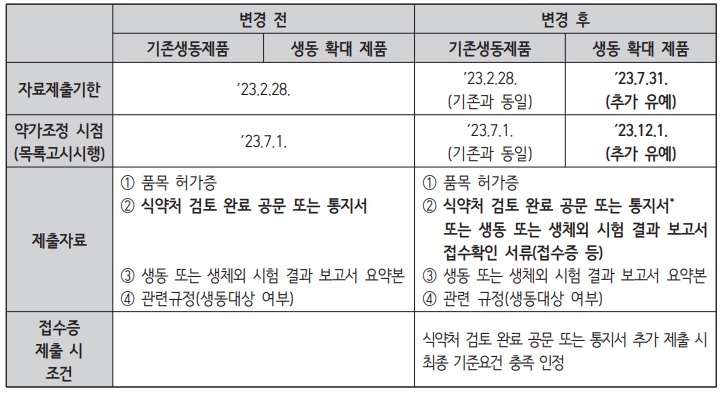
이에 따라 전문의약품 경구제 중 정제, 캡슐제, 좌제 등 기존 생동의무 품목의 경우 오는 2월 말까지 자료제출을 완료해야 한다.
다만, 신규로 생동 의무대상으로 지정된 성분을 주성분으로 하는 일부 전문의약품 경구제와 주사제, 점안제 등 무균제제는 오는 7월 말까지 자료를 제출해야 한다. 사실상 자료 제출기간을 유예 받은 셈이다.
심평원은 제약사로부터 자료를 제출 받은 후 기준요건 충족 여부에 따라 품목의 상한금액을 각 15%씩 차등 조정할 예정이다.
구체적으로 재평가에 따라 제약사 품목이 기준요건 2가지 모두 충족할 경우 '상한금액 기준 조정 가격'이지만, 1가지만 충족할 경우 상한금액 조정 기준 가격의 '85%' 가격으로 깎이게 된다. 만약 2가지 모두 충족하지 못할 경우 상한금액 조정 기준 가격의 '72.25%'로 약가가 더 내려가 제약사 입장으로서는 손해가 될 수 있다.
이 같은 배경 탓에 지난해 말 심평원이 약가 참조국에 호주를 포함하려던 것을 제약업계가 강하게 반대했던 이유이기도 하다.
호주가 제네릭 약가가 세계에서 최저가 수준으로 알려진 탓인데 만약 참조국에 호주가 들어갈 경우 기등재 의약품 재평가에 영향을 줄수 있다는 것이다.
이 가운데 제약업계에서는 기등재 의약품 재평가를 앞두고 지난해 생동성 시험 포기현상이 두드러졌다고 평가했다.
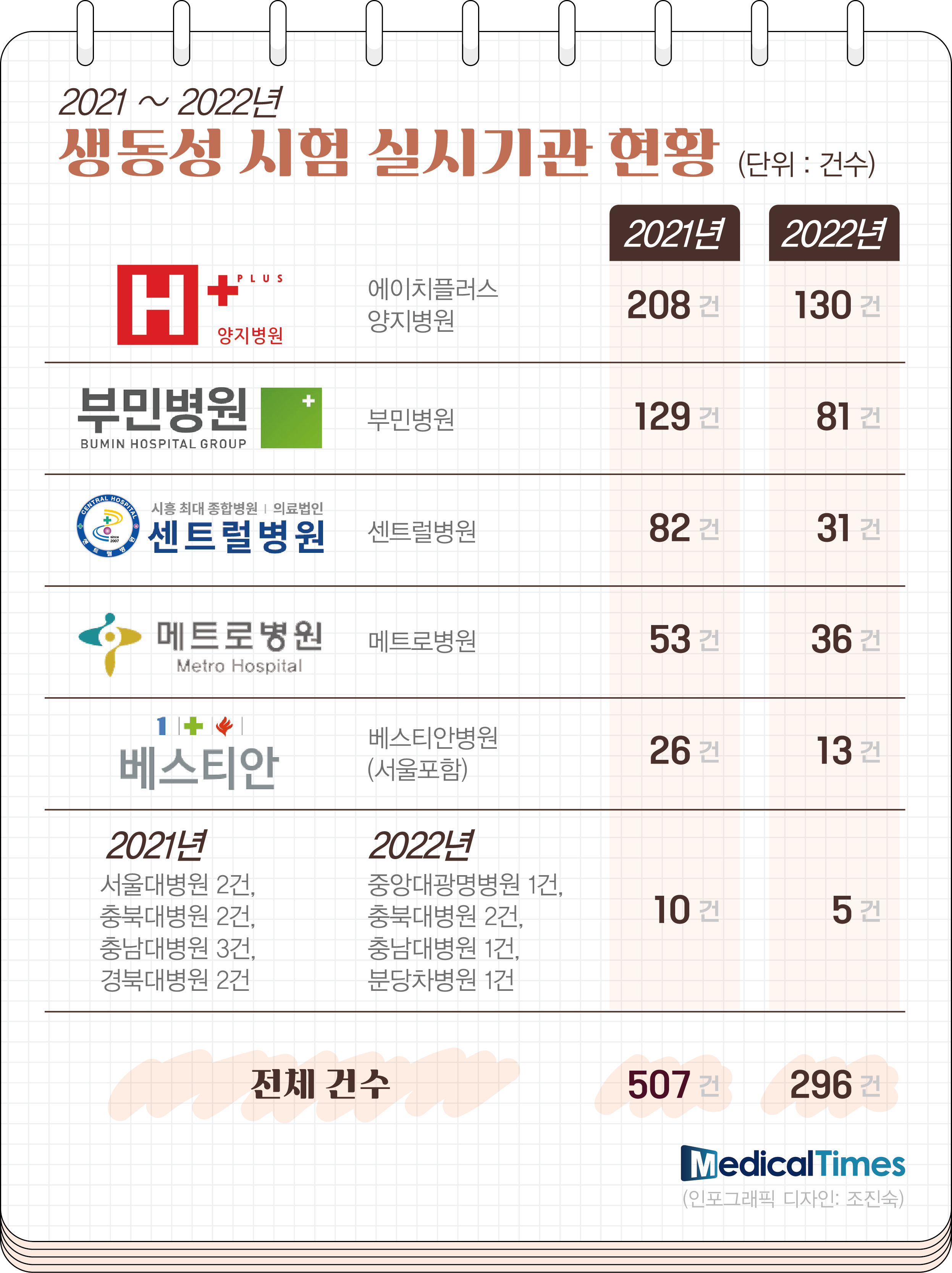
실제로 식약처에 따르면, 2021년 507건에 이르렀던 생동성 시험 건수가 2022년 296건으로 급감했다.
2022년로만 한정한다면 상반기에 209건이 진행 된 후 하반기에는 고작 87건의 생동성 시험이 진행되거나 완료됐다.
더구나 제약업계에서는 재평가를 앞두고 생동성 시험에 소요되는 금액이 증가하면서 부담은 더 가중됐다고 하소연하고 있다.
불과 몇 년 사이 생동성 시험 수행에 따른 금액이 상승해 최근에서는 3~6억원까지 증가했다는 평가가 지배적이다.
익명을 요구한 국내 제약사 관계자는 "지난해 상반기까지가 제약사의 생동성 시험을 한창 진행했을 시기였다"며 "정부의 약가 재평가 압박 속에서 서둘러 생동성 시험을 진행하기 바빴다. 하반기부터는 약가 재평가 속에서 제네릭을 포기하는 분위기로 정리되면서 생동성 시험 진행이 급감했던 것"이라고 설명했다.
그는 "동시에 잇따른 의약품 불순물 검출로 인해 정부가 제네릭 허가제도를 강화함에 따라 생동성 시험 자체에 대한 요구도가 지난해 떨어지면서 감소한 영향도 존재한다"고 말했다.








