대한치매학회, 춘계학술대회서 도나네맙 임상 탑라인 공개
아밀로이드 수치, 아두카누맙 17%↓도나네맙 65.2%↓
일라이릴리가 개발중인 알츠하이머 신약 도나네맙의 효용 및 안전성을 확인할 수 있는 지표가 공개됐다. 앞서 승인된 아두헬름(성분명 아두카누맙)과의 헤드 투 헤드 연구에서 더 강화된 아밀로이드 감소 효과를 보이며 승인 가능성에 기대감을 높였다.
15일 대한치매학회는 백범김구기념관에서 춘계학술대회를 개최하고 최근 주목받고 있는 알츠하이머 신약 도나네맙의 승인 가능성을 점검했다.
뇌 속 아밀로이드 단백질 축적이 신경 독성을 유발, 치매의 주 원인이 된다는 아밀로이드 베타 가설에 기반한 다양한 알츠하이머 치료제 신약이 개발되고 있다.
2021년 아밀로이드 베타 제거 기전의 아두카누맙이 미국 FDA의 문턱을 넘어선 이후 지속적인 효과 논란에 시달리면서 오히려 비슷한 기전의 치료제에 평가 척도로 활용될 수 있는 가능성이 제기되고 있다.
아두카누맙과의 비교에서 강화된 효과 및 안전성의 입증을 통해 규제기관의 승인을 가능성을 가늠해볼 수 있다는 것.
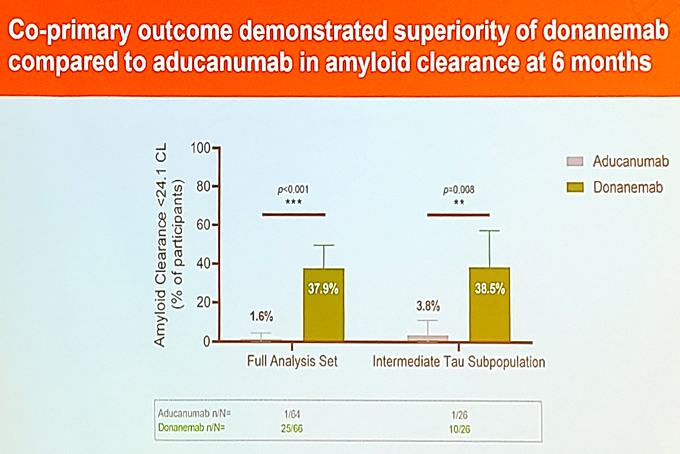
이날 치매학회는 도나네맙과 아두카누맙을 비교한 TRAILBLAZER-ALZ4 임상 탑라인 결과를 공개하며 도나네맙 승인 가능성에 무게감을 실어줬다.
미국 브라운의대 신경과 스티븐 샐로웨이 등이 진행한 해당 임상은 도나네맙과 아두카누맙 모두 아밀로이드 베타 단백질 제거 기전을 갖는다는 점에 착안, 두 약제간 아밀로이드 제거 효과를 비교토록 설정됐다.
미국 31개 의료기관에서 진행된 임상은 50~85세의 초기 알츠알츠하이머 환자를 대상으로 매 4주마다 도나네맙 700~1400mg(n = 74), 1~10mg/kg 아두카누맙(n = 74)을 76주까지 투약한 후 결과를 살폈다.
분석이 가능한 풀 데이터는 도나네맙이 66명, 아두카누맙이 64명이었다.
투약 6개월 후 비교 분석 결과 24.1 센틸로이드 미만으로 설정된 아밀로이드 제거 달성률은 아두카누맙이 64명 중 1명(1.6%)이었던 것에 반해 도나네맙은 25명(37.9%)로 확연한 차이를 보였다.
이어 PET으로 확인한 결과 기저치에서 아밀로이드 센틸로이드 수치는 아두카누맙이 17% 감소에 그친 반면 도나네맙은 65.2%가 감소했다.
알츠하이머 위험군에서 인지 저하 가능성을 예측, 진단하는 바이오마커 p-tau217 역시 차이가 분명했다. 투약 6개월 후 아두카누맙 투약군은 오히려 2.8% 증가했지만 도나네맙은 25% 감소하며 승기를 잡은 것.
아두카누맙에서 아밀로이드 관련 영상 이상 부종(ARIA-E)이 주요 부작용으로 보고된 가운데 두 약제간 평가에선 근소하게 도나네맙이 더 안전한 것으로 나타났다.
아두카누맙의 ARIA-E는 16명, 도나네맙은 15명이 발생했고 아밀로이드 관련 미세출혈(ARIA-H)은 두 약제 모두 10명으로 같았다.
이날 탑라인 결과를 발표한 스테판 에펠바움(Stephane Epelbaum) 릴리 부사장은 "투약 6개월 비교 분석에서 도나네맙은 아두카누맙 대비 아밀로이드 축적 제거에서 우월한 효과를 나타냈다"며 "도나네맙의 빠르고 강한 아밀로이드 제거 효과는 알츠하이머의 핵심 바이오마커인 p-tau 지표 개선과도 연결된 것으로 보인다"고 설명했다.
그는 "특히 빠르고 강한 효과에도 불구하고 아밀로이드 베타 가설 기반 약제의 주요 부작용인 ARIA 발생에서도 도나네맙은 상대적으로 안전했다"며 "TRAILBLAZER-ALZ 4 임상은 현재 진행중으로 12개월, 18개월째의 추가 분석이 예정돼 있다"고 덧붙였다.








