심평원, 약평위 심의 결과 공개…허가 4개월 만에 초고속 행보
2형 당뇨병 관련 만성 신장병 신약 '케렌디아' 급여 적정성 인정
국산 신약 렉라자(레이저티닙, 유한양행)도 아스트라제네카의 항암 신약 타그리소의 뒤를 이아 폐암 1차 치료제로서 급여권 진입을 목전에 뒀다.
건강보험심사평가원은 12일 2023년 제11차 약제급여평가위원회를 열고 이같은 결론을 내렸다.
지난 8월 암질환심의위원회에서 렉라자의 'EGFR 엑손 19 결손 또는 엑손 21(L858R) 치환 변이된 국소진행성 또는 전이성 비소세포폐암 환자의 1차 치료'에 대해 급여기준을 설정한 데 이어 약 두 달 만이다. 지난 6월 말 1차 치료제로 식품의약품 허가를 받은 후 불과 4개월 만에 급여 확대를 위한 관문을 모두 넘어선 셈이다.
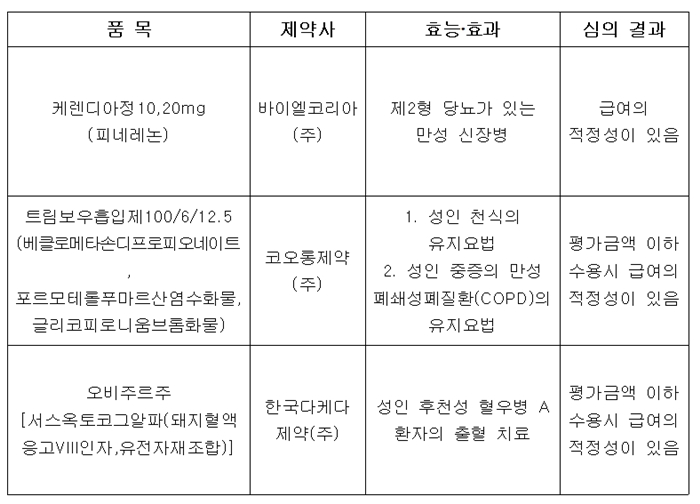
약평위는 제2형 당뇨가 있는 만성 신장병 신약 케렌디아(피네레논, 바이엘)에 대해서도 급여 적정성이 있다는 결론을 내렸다.
다만, 2개 신약에 대해서는 약평위가 제시하는 금액 이하를 수용했을 때 급여 적정성이 있다고 봤다. 중증 만성폐쇄성폐질환(COPD) 치료제 트림보우흡입제 100/6/12.5(베클로메타손디프로피오네이트, 포르모테롤푸마르산염수화물, 글리코피로니움브롬화물, 코오롱제약)와 다케다 제약의 혈우병약 오비주르[서스옥토코그알파(돼지혈액응고VIII인자,유전자재조합]다.
약평위를 통과한 약은 건강보험공단과 약가협상을 진행한다. 심평원은 약평위 심의를 거쳐 약제의 급여적정성 등을 평가하고 있다. 해당 약제의 세부 급여범위 및 기준품목 등의 변동사항, 결정신청한 품목의 허가사항 변경 및 허가취소 등이 발생하면 최종 평가 결과가 바뀔 수 있다.








