EMA에 옵디보+젬시스 병용요법 허가신청 발표
30년 유지된 젬시스 요법 대체 가능 '평가'
브리스톨 마이어스 스퀴브(BMS)가 유럽의약품청(EMA)에 '옵디보(니볼루맙)'의 전이성 요로상피암 1차 치료제 승인을 신청했다.

옵디보에 항암화학요법을 병용한 것으로, 지난 달 열린 유럽임상종양학회 연례학술회의(ESMO Congress 2023)에서 발표된 CheckMate 901 연구가 바탕이 됐다.
BMS는 지난 달 30일 전이성 요로상피암 환자 1차 약제로 옵디보와 시스플라틴 기반 화학요법 병용요법을 EMA에 허가를 신청했다고 발표했다.
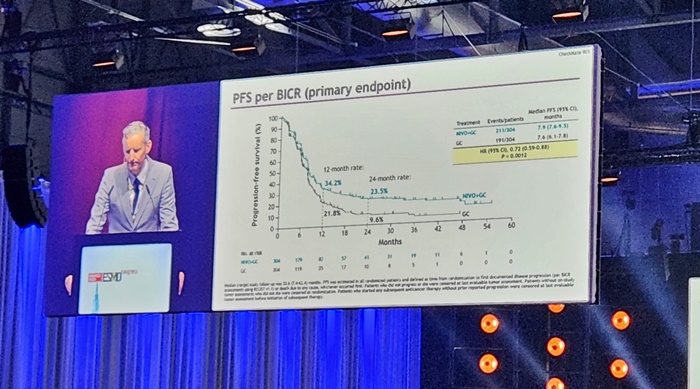
이번 허가 신청은 전이성 요로상피암 환자 608명을 대상으로 옵디보와 표준요법인 젬시타빈+시스플라틴 병용요법(젬시스)을 평가한 CheckMate 901 연구 결과가 밑바탕이다.
연구 결과에 따르면, 중앙 추적관찰 36개월 시점에 1차 평가변수인 전체생존기간(Overall Survival, OS) 중앙값은 옵디보 추가군이 21.7개월, 대조군은 18.9개월로 옵디보 추가군이 치료 성적 개선이 확인됐다.
또 다른 1차 평가변수인 무진행생존기간(Progression-Free Survival, PFS) 중앙값은 옵디보 추가군이 7.9개월, 대조군이 7.6개월로 옵디보 추가군의 질병 진행 또는 사망의 위험이 28% 더 낮았다.
이 같은 CheckMate 901 연구 결과가 밑바탕이 돼 EMA에 1차 치료 허가 신청으로 이어진 것으로 풀이된다.
EMA에 빠른 허가가 이뤄지기만 한다면 기존 30년 동안 유지되던 젬시스 요법을 대체하는 1차 치료로 자리 잡을 것으로 기대된다.
한편, ESMO 2023에서는 옵디보와 함께 항체약물접합체(Antibody-Drug Conjugates, ADC) 파드셉과 면역항암제 키트루다(펨브롤리주맙) 병용요법을 백금기반 항암화학요법과 비교 평가한 EV-302/KEYNOTE-A39 3상 임상 결과도 공개된 바 있다.
파드셉 임상의 경우 1차 평가변수인 PFS 중앙값은 파드셉 병용요법이 12.5개월로 대조군인 항암화학요법 6.3개월 비교해 큰 개선을 이뤄냈다. 또 다른 1차 평가변수인 OS 중앙값도 31.5개월로 나타나 대조군 16.1개월보다 두 배 가까이 연장하는데 성공했다.
옵디보와 마찬가지로 전이성 요로상피암 1차 치료를 직접 겨냥한 임상임에 따라 향후 1차 치료 승인 여부에 따라 직접적인 치료제 시장에서 경쟁 대상이 될 전망이다.








