'베마리투주맙-면역항암제' 병용 임상 3상 돌연 중단 결정
ESMO 2025서 발표된 'FORTITUDE-101' 연구 맞물려 주목
전이성 위암 새로운 표적 치료제로 주목 받던 '베마리투주맙(Bemarituzumab)' 향후 행보에 관심이 쏠리고 있다.
새로운 치료 옵션으로서 탈바꿈하는 갈림길에 서 있기 때문이다.

12일 제약업계에 따르면, 최근 암젠은 3분기 실적 발표 자리에서 위암 1차 치료제로 베마리투주맙과 화학요법(mFOLFOX6), 항 PD-1 면역항암제(니볼루맙) 병용요법 효과를 확인하기 위한 FORTITUDE-102 임상 1b/3상 시험을 중단한다고 밝혔다.
암젠이 개발 중인 단클론항체 '베마리투주맙'은 위암 치료에서 새로운 바이오마커로 주목받는 'FGFR2b(Fibroblast growth factor receptor 2 isoform IIIb)' 단백질을 표적으로 개발 중인 약물이다.
현재 전이성 위암 치료에서는 'HER2' 단백질이 대표적인 바이오마커로 활용되고 있으며, HER2 양성 위암 환자는 '트라스투주맙'을 포함한 표적 치료가 표준 치료법으로 사용되고 있다.
또한 최근에는 위암 환자의 약 40%에서 발현되는 '클라우딘 18.2(Claudin 18.2)' 단백질이 새로운 표적으로 제시되고, 이를 타깃한 표적항암제(졸베툭시맙, 아스텔라스)가 개발되면서 임상현장에서 주요 옵션으로 활용되고 있다.
여기에 또 하나의 위암 치료옵션 등장여부에 주목을 끌고 있는 상황.
이에 따라 진행된 FORTITUDE-102 연구는 FGFR2b 과발현(종양 세포의 10% 이상)이 있는 절제 불가능한 진행성 또는 전이성 위암 및 위식도 접합부 암 환자를 대상으로 진행됐다.
환자들은 베마리투주맙+화학요법+니볼루맙 병용투여군과 위약+화학요법+니볼루맙 투여군으로 무작위 배정됐다. 이는 현재 표준 치료법(면역항암제 포함) 대비 베마리투주맙의 추가 효과를 검증하는 목적이었다.
하지만 암젠은 당초 예상보다 빠르게 임상 조기 중단 결정을 내렸다. 기대했던 것보다 효능이 부족한 데에 따른 것이란 분석이다.
이 과정에서 베마리투주맙이 더 주목받는 이유는 최근 유럽종양학회 연례학술대회(ESMO 2025)에서 공개된 'FORTITUDE-101' 연구 결과와 맞물리기 때문이다.
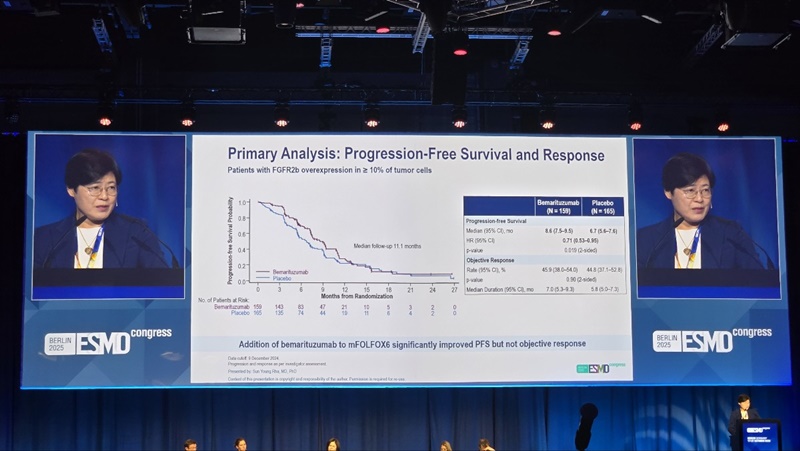
해당 연구는 베마리투주맙과 화학요법(mFOLFOX6) 병용의 유효성과 안전성을 평가하기 위해 설계된 것으로, FORTITUDE-102 임상과 비교하면 면역항암제만 제외한 것이다. 연구는 절제 불가능하거나 전이된 HER2 음성 위암 및 위식도 접합부 암 환자 547명을 대상으로 진행됐다.
그 결과, 추적관찰 11.8개월차 중간 분석에서 베마리투주맙 병용군의 전체생존기간 중앙값(mOS)은 17.9개월로, 위약군의 12.5개월에 비해 유의하게 연장됐다.(HR 0.61)
무진행생존기간 중앙값(mPFS) 역시 8.6개월 대 6.7개월로 긍정적인 결과를 보였다.(HR 0.71)
다만, 객관적반응률(ORR)은 45.9% 대 44.8%로 큰 차이가 없는 것으로 나타났으며, 19.4개월 시점에 진행한 최종 분석에서는 mOS도 각각 14.5개월과 13.2개월로 큰 차이가 없었다.(HR=0.82, 95% CI 0.62-1.08)
이상반응 면에서도 FGFR2b 항체의 특징적인 부작용인 안구 독성(시력 저하, 점상 각막염, 안구 건조 등)이 문제가 됐다. 베마리투주맙 환자의 33%가 시력 저하(visual acuity reduced)를 경험했으며, 26%는 점상각막염(punctate keratitis)을 겪는 등 각막 병변을 겪었다. 그나마 대부분의 환자에서 시력 저하 및 각막 손상은 가역적(reversible)이었으며, 상당수가 회복 가능한 것으로 나타났다.
결과적으로 FGFR2b 단백질을 표적으로 한 베마리투주맙을 둘러싼 암젠의 결정에 향후 관심이 집중되는 모양새다.
이를 두고 암젠 측은 "1차 위암 환자를 대상으로 베마리투주맙과 화학요법, 니볼루맙을 병용하는 1b/3상 연구인 FORTITUDE-102가 중단됐다"며 "베마리투주맙 단독요법 연구인 FORTITUDE-301은 FGFR2b 과발현이 있는 고형 종양 환자를 대상으로 진행 중"이라고 설명했다.








