한림제약 간판 품목 '엔테론' 안과 영역 적응증 변화 불가피
정부 의약품 재평가 속 매출 상승…처방액 지켜낼지 관심
1년 간의 급여 재평가 속에서 구사일생으로 살아남은 한림제약 엔테론(포도씨건조엑스)이 결국 임상 재평가에 발목이 잡혀 효능‧효과가 축소된다.
엔테론의 적응증 중 '안과' 영역의 적응증이 이전보다 줄어드는 것으로 이로 인한 매출 감소는 피하기 힘들 것으로 전망된다.
4일 제약업계에 따르면, 식품의약품안전처는 포도씨건조엑스 50mg 단일제(정제)인 한림제약의 엔테론에 대한 허가 사항 변경 명령을 사전 예고했다.
앞서 한림제약은 지난해 상반기 엔테론이 임상 재평가 대상에 지정되면서 의약품 주요 적응증에 대한 재평가 계획서를 식약처에 제출한 바 있다.
엔테론의 주요 적응증을 보면 ▲정맥림프 기능부전 관련 증상개선(하지둔중감, 통증, 하지불안증상) ▲유방암 치료로 인한 림프부종(피부긴장 자각증상 등)의 물리 치료 시 보조요법 병용 ▲망막·맥락막 순환 관련 장애 치료 시 특정 원인요법 병용 등(50mg에 한함)으로 요약된다.
이 중 50mg 용량에만 해당하는 세번째 안과 적응증이 이번 임상 재평가(150mg 제외)로 인해 허가 사항이 변경되는 것이다.
식약처가 예고한 허가 변경안을 보면 기존 '망막·맥락막 순환 관련 장애 치료 시 특정 원인요법 병용 등'에서 '당뇨 원인요법과 병용해 제2형 당뇨병 환자의 황반부종을 동반하지 않은 비증식성 당뇨망막병증(DRSS level 35~47)에 보조제로 투여'하는 것으로 변경된다.
기존보다 적응증이 특정된다는 점에서 병‧의원의 처방 자율성이 축소되는 것으로 해석된다. 엔테론의 허가 변경안은 현재 2월 11일 적용 예정이다.
식약처 측은 "업체에서 제출한 임상재평가 자료(임상시험 계획서)를 토대로 당해 품목의 허가사항을 변경 명령할 예정"이라며 "병∙의원에서는 포도씨건조엑스 50mg 복용 환자의 대체 의약품 처방∙조제 필요성 등을 면밀하게 검토해 적절히 처방할 수 있도록 협조를 당부한 상황"이라고 전했다.
한편, 한림제약으로서는 주력 품목인 엔테론의 효능‧효과가 일정부분 축소되면서 매출 타격도 불가피할 것으로 보인다.
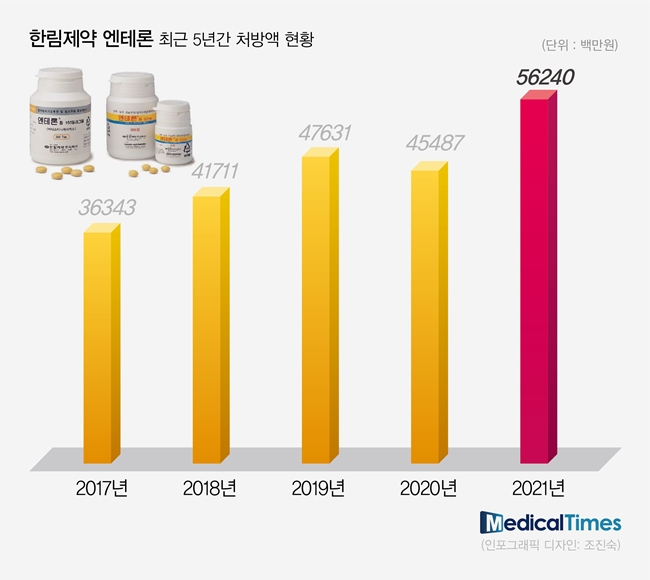
특히 정부가 급여와 임상 재평가를 동시에 진행하는 와중에도 지난해 엔테론의 처방액은 오히려 늘어나는 기현상이 나타났다는 점에서 매출 추이에 더욱 관심이 모아지고 있는 상황.
정부의 의약품 재평가 의지와는 전혀 다르게 의료 현장에서는 처방이 이어졌다는 것을 의미하기 때문이다.
실제로 의약품 조사기관 유비스트에 따르면, 2021년 엔테론의 전체 합산 외래 처방액은 약 562억원이다. 이는 전년도(약 455억원) 보다 24% 늘어난 수치다.
흉부외과의사회 김승진 회장(센트럴 흉부외과)는 "엔테론의 경우 하지 정맥 치료와 함께 부종, 혈액 순환에서 처방되고 있으며 흉부외과 병‧의원뿐만 아니라 정형외과 등 다양한 진료과목에서 처방되는 대표적 의약품"이라며 "정부의 급여, 임상 재평가에 불구하고 처방이 오히려 늘어난 이유는 의료 현장에서 이미 약물의 효과를 경험했기 때문"이라고 설명했다.
다만, 안과 분야의 효능‧효과 변화로 인해 향후 처방액의 변화가 발생할 수 있다는 전망도 공존한다.
익명을 요구한 한 제약업계 관계자는 "지난해 건강보험심사평가원이 진행한 급여 재평가 대상 중 유일하게 살아남았던 것이 엔테론"이라며 "다만, 이 과정에서 유방암 적응증은 항목에서 빠졌지만 매출에 큰 부분이 아니라 제약사가 정부 지침에 대응을 잘한 사례로 남았었다"고 언급했다.
그는 "하지만 하지정맥류 치료와 함께 매출이 큰 부분을 차지하는 안과 분야의 적응증이 임상 재평가를 계기로 변화한다면 병‧의원에 처방에도 영향을 끼칠 수 있다"며 "향후 매출 면에서 변화가 발생할 수 있다고 본다"고 덧붙였다.








